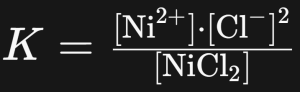Kesetimbangan kimia dalam sistem nickel chloride (NiCl2) melibatkan reaksi antara ion nickel (Ni2+) serta ion chloride (Cl-) dalam larutan. Hal ini memiliki persamaan kimia berikut:
NiCl2 (aq)⇌Ni2+(aq)+2Cl−(aq)
Pada suhu tertentu, laju bereaksi ke kanan (pembentukan Ni2+, Cl-) dan laju reaksi ke kiri (pembentukan NiCl2 atau nikel chloride) menjadi setara, sehingga mencapai kesetimbangan kimia. Pada titik ini, zat-zat terlibat dalam reaksi tidak mengalami perubahan signifikan dari waktu ke waktu.
Ada beberapa faktor yang mempengaruhi setimbangan kimia nickel chloride, termasuk suhu, tekanan, juga konsentrasi awal reagen.
Kesetimbangan Kimia Nickel Chloride Faktor-Faktor
1. Suhu:
Suhu memiliki pengaruh signifikan pada kesetimbangan kimia. Peningkatan suhu cenderung mendorong reaksi ke endothermic (menyerap panas), atau sebaliknya. Dalam konteks nikel chloride, jika bereaksi ke pembentukan Ni2+(nickel) dan Cl- (chloride) bersifat endothermic, peningkatan suhu akan meningkatkan konsentrasi produk tersebut pada ekuilibrium.
2. Tekanan:
Dalam reaksi kimia yang melibatkan gas, tekanan dapat mempengaruhi kesetimbangan. Jika nickel klorida bereaksi melibatkan gas (misalnya, jika ada gas Cl2 yang terlibat), perubahan tekanan dapat menggeser K. Namun, karena persamaan di atas tidak melibatkan gas, tekanan mungkin memiliki pengaruh yang lebih kecil dalam hal ini.
3. Konsentrasi Awal:
Konsentrasi awal reagen juga mempengaruhi kesetimbangan. Jika Anda memulai dengan konsentrasi awal yang tinggi dari salah satu reagen, reaksi akan cenderung bergerak ke arah yang berlawanan untuk mencapai ekuilibrium. Sebaliknya, jika concentration awal produk tinggi, ini akan cenderung ke arah pembentukan produk tersebut.
Selain faktor-faktor di atas, konsep dasar hukum aksi massa serta K juga relevan. K adalah hasil bagi antara hasil kali konsentrasi ion produk dibagi oleh hasil kali konsentrasi ion reagen. Perubahan kondisi reaksi dapat mempengaruhi nilai K juga menggeser ekuilibrium ke arah yang diinginkan.
Konsep dasar hukum tersebut serta konstanta kesetimbangan (K) merupakan elemen penting dalam memahami juga menggambarkan hal ini. Mari kita bahas rinci kedua konsep ini.
Konsep Dasar Kesetimbangan Kimia Nickel Chloride
Hukum Aksi Massa:
Hukum aksi massa, atau lebih dikenal sebagai hukum laju reaksi yang diperkenalkan oleh Guldberg dan Waage pada tahun 1864, menyatakan bahwa laju kimia pada suhu tertentu sebanding dengan hasil kali konsentrasi masing-masing reagen, setiap reagen dihentikan pada suhu tetap.
Dalam konteks nickel chloride, hukum ini memberikan gambaran tentang bagaimana konsentrasi nickel (Ni2+), chloride (Cl-), juga Nickel chloride berkaitan dengan laju reaksi. Persamaan setimbang yang melibatkan concentration masing-masing spesies dapat dinyatakan dengan menggunakan hukum aksi massa.
Konstanta Kesetimbangan (K):
Konstanta kesetimbangan (K) adalah nilai numerik yang mencerminkan keseimbangan relatif antara konsentrasi reagen dan produk pada suatu temperatur tertentu. Dalam konteks reaksi nickel chloride, K dapat dinyatakan sebagai berikut:
Di sini, tanda kurung siku [] menunjukkan concentration molar. Persamaan ini menggambarkan hubungan antara k ion produk (Ni2+, Cl-) dengan reagen nickel klorida. Nilai K spesifik untuk setiap reaksi dan dapat berubah tergantung pada suhu.
Pengaruh Perubahan Kondisi pada Nilai K dan Kesetimbangan:
Perubahan kondisi seperti suhu, tekanan, atau konsentrasi dapat mempengaruhi K. Jika suhu meningkat, misalnya, reaksi bersifat endothermic, K mungkin meningkat karena meningkatnya concentration ion produk pada kondisi tersebut. Sebaliknya, penurunan suhu dapat menyebabkan penurunan K.
Selain itu, ketika kita memodifikasi awal reagen atau produk, ekuilibrium akan berusaha untuk dipertahankan, dan reaksi akan bergerak ke arah yang menghasilkan hal sama yang baru. Pemahaman tentang bagaimana perubahan kondisi merubah nilai K juga menggeser ekuilibrium penting dalam merancang serta mengoptimalkan proses kimia.
Kesetimbangan kimia dalam sistem nickel chloride (NiCl2) adalah fenomena yang kompleks juga dapat dipahami lebih rinci dengan mempertimbangkan aspek-aspek tertentu seperti struktur molekuler, pengaruh suhu, dan efek konsentrasi. Mari kita perinci lebih lanjut beberapa aspek tersebut.
Struktur Molekuler:
Nickel chloride terdiri dari nickel (Ni2+) serta chloride (Cl-). Struktur molekuler ini memainkan peran penting dalam kimia. Nickel (Ni) adalah logam transisi dengan sifat elektronik khas, termasuk kemampuan untuk membentuk ion dengan berbagai tingkat oksidasi. Ion Ni2+( nickel ) merupakan kontributor utama dalam pembentukan kesetimbangan.
Ion chloride (Cl-) adalah anion yang bersifat sangat reaktif dan cenderung membentuk ikatan ion dengan kation logam. Kedua ion ini bersatu dalam larutan, serta reaksi ekuilibrium menggambarkan keseimbangan antara pemisahan nikel chloride dan pembentukan ion Ni2+, ion Cl-. Pemahaman struktur molekuler membantu dalam merinci interaksi kimia yang terlibat.
Efek Konsentrasi:
Konsentrasi awal reagen dan produk juga memainkan peran signifikan. Menambahkan lebih banyak nickel klorida awalnya dapat mendorong reaksi ke pembentukan ion Ni2+ ( nickel ) dan ion Cl-. Sebaliknya, jika kita memulai dengan konsentrasi tinggi ion Ni2+ dan ion Cl-, ini akan bergerak ke arah pembentukan nikel chloride. Pemahaman terhadap perubahan ini selama reaksi adalah kunci untuk mengendalikan kesetimbangan.
Penting untuk diingat bahwa kesetimbangan kimia tidak selalu mencapai nol konsentrasi. Hal ini menciptakan suatu keadaan di mana laju reaksi ke arah kanan sama dengan ke kiri, sehingga tidak ada perubahan netto dalam konsentrasi produk dan reagen.
Konstanta Kesetimbangan (K):
K merupakan nilai yang menggambarkan sejauh mana ekuilibrium telah tercapai pada suhu tertentu. Perhitungan K melibatkan konsentrasi masing-masing spesies kimia dalam persamaan. Nilai K yang besar menunjukkan dominasi produk, sedangkan nilai K kecil menunjukkan dominasi reagen.
Hubungi kami sekarang untuk mendapatkan informasi lebih lanjut, atau pemesanan produk.